Analisi in vivo di reti neuronali - l'informazione in diretta
Sensori multicanale e i cervelli del futuro.
(A cura di Davide Regaldo, Università degli Studi di Torino)
La fisica dei processi biologici: i neuroni
La biofisica studia i problemi biologici con metodi e tecnologie tradizionalmente utilizzati in fisica, ed in particolar modo si occupa anche di analizzare i processi biologici che coinvolgono piccole unità o sistemi di unità, come le cellule del corpo umano, le loro interconnessioni ed i messaggi che si scambiano. Tra le cellule di grande interesse biofisico vi sono i neuroni, ossia le unità di calcolo e di memoria principali del nostro cervello. Lo studio dei neuroni e della rete che essi creano mediante le loro interconnessioni è fondamentale per comprendere la genesi e l’evoluzione di malattie o sindromi ad essi associate, come il morbo di Parkinson. Inoltre è utile per capire come tali malattie possono essere trattate mediante la somministrazione di farmaci che influiscono sulle funzionalità neuronali.
Un laboratorio di ricerca
Uno dei luoghi in cui si conduce la ricerca sui neuroni è il laboratorio di ricerca del Dipartimento di Scienza e Tecnologia del Farmaco, in cui farmacisti, chimici delle tecnologie farmaceutiche, biologi e fisici collaborano per studiare i neuroni e i segnali chimici ed elettrici che essi si scambiano. Il laboratorio possiede diverse apparecchiature sperimentali per estrarre, conservare, osservare e analizzare i neuroni. Questi si possono osservare al microscopio ottico, dato che le loro dimensioni sono dell’ordine del micron, inoltre si possono registrare i segnali che trasmettono utilizzando una coppia di elettrodi, uno all’interno, ed uno all’esterno della membrana: questa tecnica è chiamata patch clamp. Un segnale neuronale consiste in una variazione del potenziale di membrana ed è chiamato potenziale d’azione. Il potenziale di membrana è definito come la differenza di potenziale elettrico tra l’interno e l’esterno della membrana cellulare. La sua forma caratteristica è mostrata in figura 1.
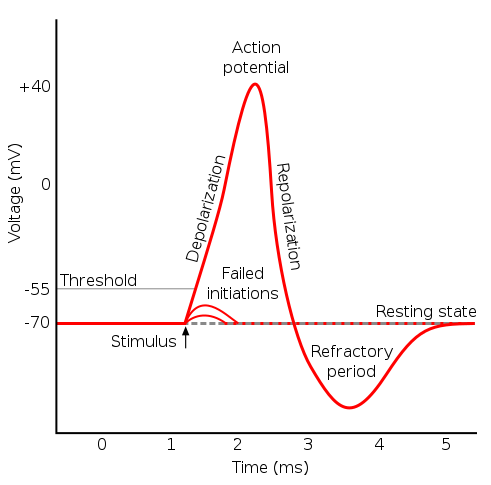
Figura 1: potenziale d’azione neuronale, la variazione del potenziale di membrana è possibile grazie al passaggio di ioni attraverso la membrana, tramite specifici canali.
Quando si ha a che fare con un neurone, si possono misurare sia differenze di potenziale, sia correnti di membrana costituite dal passaggio di ioni attraverso di essa.
Il MEA
Tra gli strumenti utilizzati per lo studio dei segnali neuronali, in questo laboratorio si utilizza uno strumento di misura chiamato MEA (micro electrode array). Il MEA è composto da una matrice quadrata di (8x8) elettrodi in silicio, di cui solo 60 attivi (figura 2, figura 3), uno di questi elettrodi è collegato a massa e funge da elettrodo di terra. Il grande numero di elettrodi è necessario per osservare il comportamento di più neuroni contemporaneamente, cosa che diventa rilevante soprattutto per una coltura matura. La matrice di elettrodi sopra citata è completamente immersa in un isolante elettrico (vetro), il quale è ricoperto da un poliammide biocompatibile che funge anche da piastra di coltura per le cellule che possono essere sopra depositate.

Figura 2: MEA microchip: dimensioni della matrice di elettrodi: 0,8 mm x 0,8 mm. Distanza tra gli elettrodi: 100 μm.

Figura 3: immagine al microscopio ottico della matrice di elettrodi del MEA con una coltura di neuroni di substantia nigra, sovrapposte (in verde) vi sono le tracce di segnale misurate da ogni elettrodo.
Sopra la superficie poliammidica possono essere depositati dei neuroni e i segnali elettrici da essi trasmessi possono essere registrati dagli elettrodi del MEA presenti nel substrato.
Da dove vengono prelevati i neuroni?
I neuroni provengono dalla substantia nigra pars compacta, una zona particolarmente interna e ancestrale del topo. In particolare, viene asportato il cervello dei feti di topo, viene separata la substantia nigra e viene posta nella piastra di coltura del MEA insieme ad una soluzione fisiologica, che ne consente la vita per diversi giorni, arrivando anche alle 2 o 3 settimane nei casi più fortunati. I neuroni, nei giorni successivi alla preparazione della coltura, possono cominciare ad estendere le loro terminazioni nervose, i dendriti e l’assone, verso i neuroni vicini, creando interconnessioni che possono infittirsi con il passare dei giorni. I campioni di coltura su MEA sono conservati in atmosfera controllata e vengono analizzati periodicamente connettendo il MEA all’interfaccia di lettura e questa ad un PC.
La registrazione dei segnali neuronali
Ogni elettrodo del MEA è in grado di registrare una traccia di potenziale in funzione del tempo, ma la lettura sfrutta l’accoppiamento capacitivo con l’ambiente di coltura in cui sono contenuti i neuroni: non vi è perciò un reale scambio di cariche tra la soluzione fisiologica e gli elettrodi, ma solo una polarizzazione di questi ultimi quando una variazione di potenziale si verifica nella soluzione fisiologica. Gli elettrodi non misurano direttamente il potenziale di membrana, ma misurano un segnale extracellulare conseguente alla variazione del potenziale di membrana. Il valore registrato dalla catena elettronica di acquisizione consiste nella derivata prima del potenziale intracellulare, cambiata di segno, ed essendo la risposta degli elettrodi capacitiva, esso è proporzionale al valore della corrente che passa attraverso la membrana (figura 4).
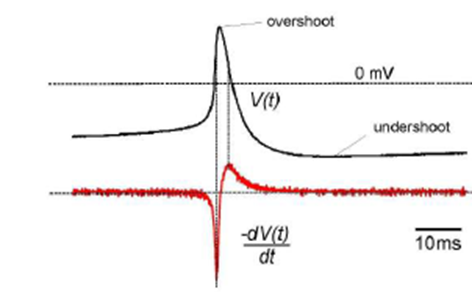
Figura 4: in nero è mostrato il potenziale d’azione neuronale, in rosso il segnale elettrico registrato da un singolo elettrodo del MEA.
I segnali extracellulari sono caratterizzati da una banda di rumore prodotta dal circuito elettronico e dal convertitore analogico-digitale (ADC) utilizzati per acquisire i segnali: l’ampiezza caratteristica di tale banda è di circa 10 μV picco-picco ed il rumore è di tipo gaussiano o bianco. I singoli segnali extracellulari si evidenziano rispetto al segnale sottostante come degli stretti e profondi picchi negativi, seguiti da un picco positivo di minore ampiezza e maggiore larghezza (figura 5).
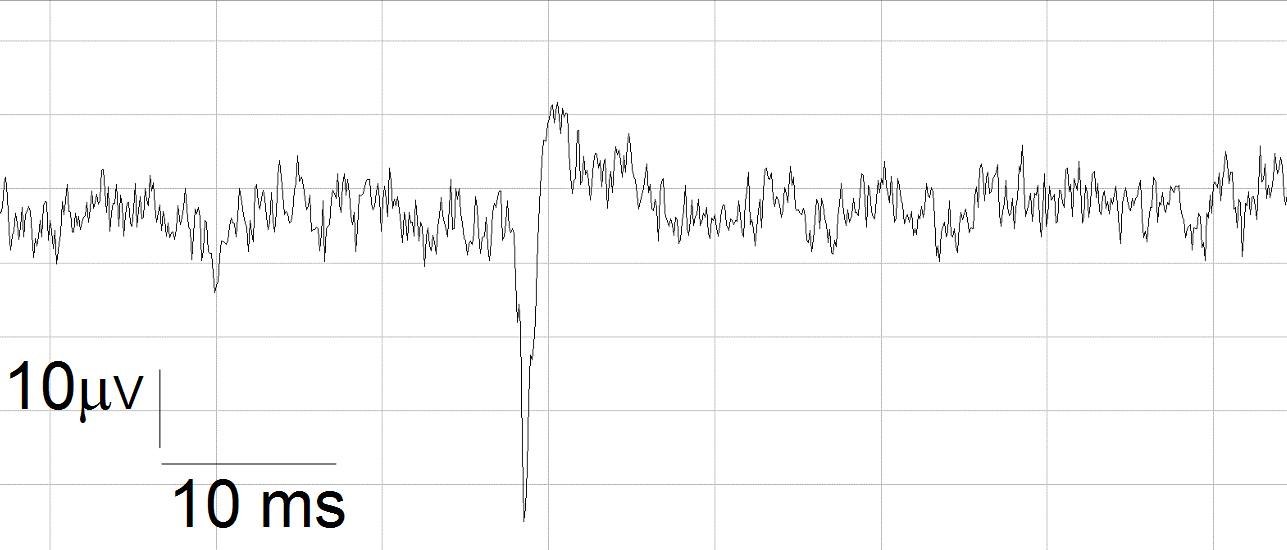
Figura 5: traccia extracellulare con potenziale d’azione.
Analisi dati delle tracce di potenziale
Nelle misure da me effettuate in laboratorio ho analizzato la frequenza media di emissione di potenziali d’azione da parte di neuroni della substantia nigra, inoltre ho raccolto informazioni riguardanti i bursts generati dai neuroni. Una traccia di segnale contenente per la maggior parte spikes (potenziali d’azione singoli) è tipica di una rete neuronale giovane, nella quale i neuroni emettono spontaneamente segnali, i quali non si propagano ai vicini a causa della mancanza di interconnessioni. Con la maturazione della rete neuronale si vengono a formare nuove connessioni, ed un singolo segnale emesso da un neurone può giungere ai vicini permettendo la generazione di altri potenziali d’azione, i quali si propagano nella rete: questo dà origine ai bursts (figura 6), che sono effettivamente dei treni di potenziali d’azione.
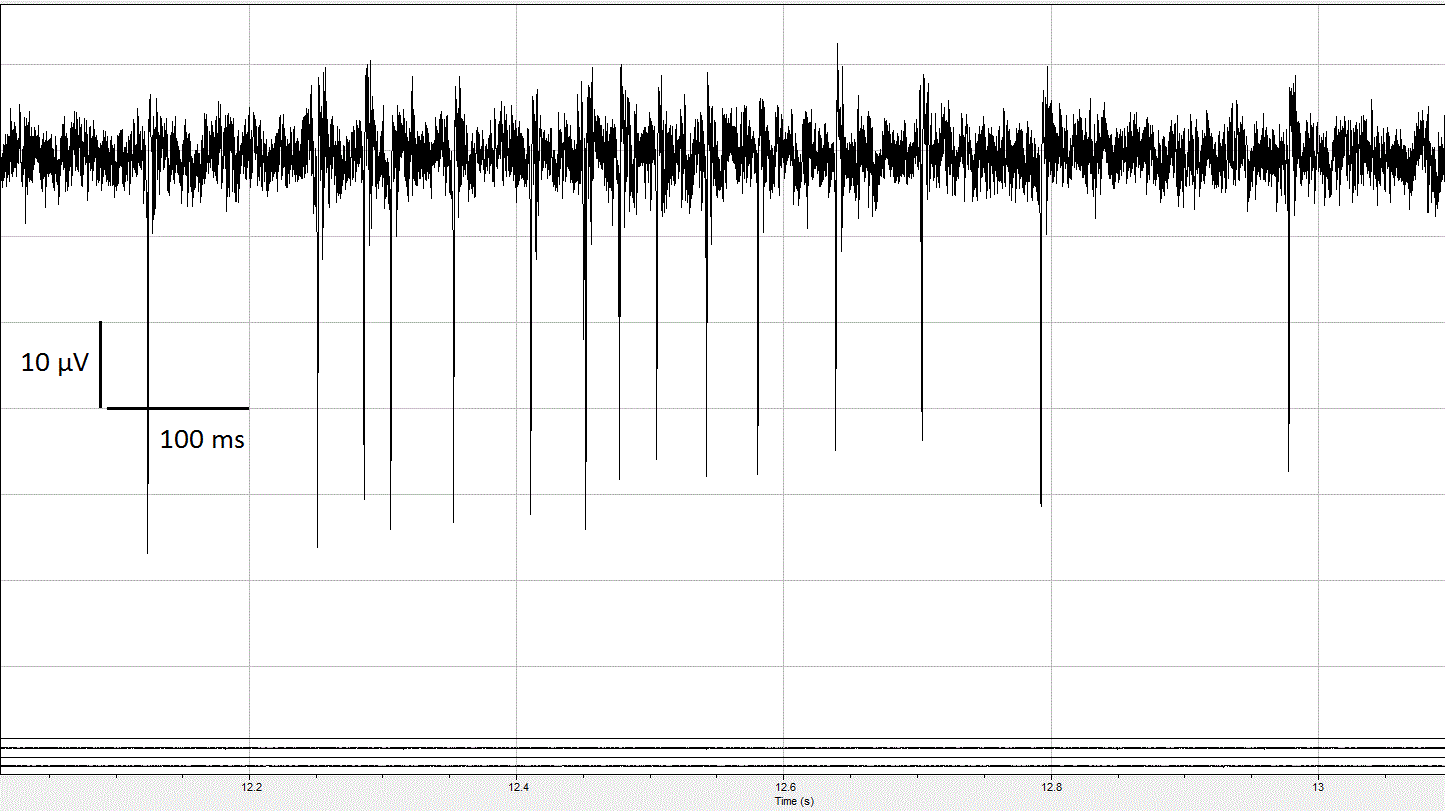
Figura 6: bursts registrato su un singolo canale in una rete neuronale matura.
Nell’analisi dati da me svolta ho calcolato due importanti caratteristiche dei bursts, ossia il numero medio e la durata media di bursts per ogni canale. In particolare, ho eseguito le misurazioni appena descritte somministrando direttamente alla soluzione fisiologica due farmaci: L-Dopa e Sulpiride. Il primo ha indotto una drastica riduzione della frequenza di emissione degli spikes, mentre il secondo farmaco ha riportato la situazione alle condizioni iniziali (Control), riattivando la produzione di potenziali d’azione (figura 7).
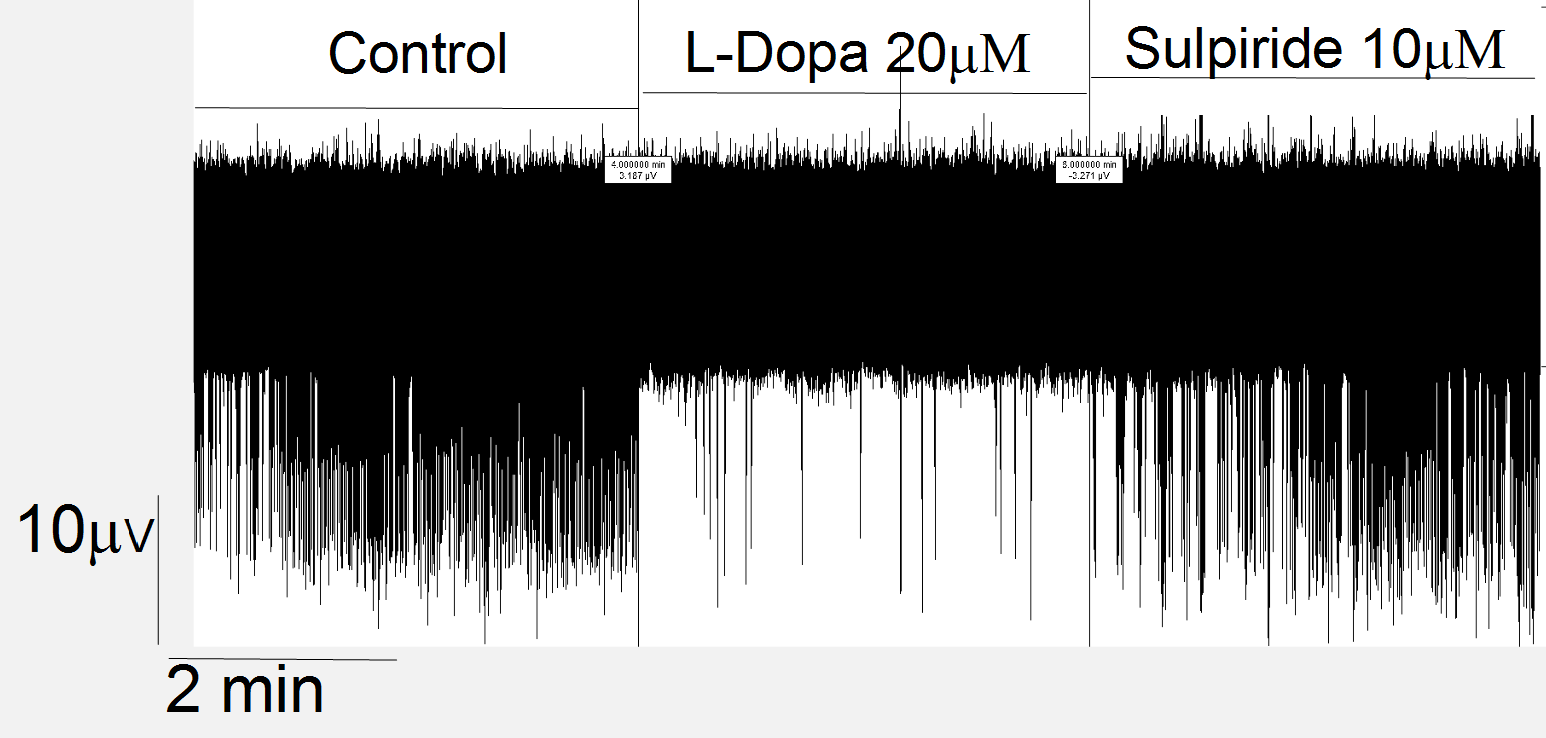
Figura 7: traccia di 12 minuti di registrazione durante la somministrazione di farmaci.
Il mio lavoro di tesi all’interno del laboratorio era incentrato principalmente sull’analisi dati dei segnali prodotti dal MEA. Tale analisi viene da anni effettuata utilizzando diversi programmi commerciali: uno per la registrazione e la discriminazione del segnale, uno per identificare i bursts in ogni traccia, ed un foglio di calcolo per elaborare i dati, produrre medie, deviazioni standard e confrontare diverse serie di misure. Questi applicativi non sono open source, ciò significa che non permettono di visionare e modificare gli algoritmi che utilizzano per trattare i dati. L’obiettivo del mio lavoro di tesi è stato quello di sviluppare un software (in MATLAB) che faccia il lavoro in parallelo, ossia che ripeta gli stessi passaggi sopra descritti, ma che sia automatizzato, permettendo così un forte risparmio in termini di tempo lavorativo. Inoltre, essendo open source, tale applicativo può essere modificato per andare incontro alle esigenze di ogni specifica analisi dati. Il mio programma è anche in grado di applicare una soglia automatica ad ogni canale, riconoscendo l’ampiezza del rumore: ciò è particolarmente importante se si considera che con un software commerciale, ogni operatore in fase di registrazione applica una soglia secondo il proprio giudizio, inserendo nell’analisi un errore certamente non trascurabile.
Conclusioni
Il lavoro di un fisico all’interno del laboratorio del dipartimento di scienza e tecnologia del farmaco, in cui ho svolto il tirocinio per la tesi triennale, è assai importante soprattutto nell’analisi dati. Sicuramente la cooperazione tra ricercatori provenienti da ambiti così diversi ha molti lati positivi: permette infatti di affrontare questa ricerca, intrinsecamente multidisciplinare, sotto diversi punti di vista, come quello chimico, biologico, fisico e farmaceutico, prendendo il meglio da ogni disciplina, oltrepassando l’approccio settoriale allo studio della natura delle cose.
Contatti utili

“Analisi in vivo di reti neuronali - l’informazione in diretta” di Davide Regaldo, Associazione Italiana Studenti di Fisica, è distribuito con Licenza Creative Commons Attribuzione - Non commerciale - Non opere derivate 4.0 Internazionale.