L’olfatto quantistico delle api
Intervista al Dr. Albrecht Haase, ricercatore del CIMeC di Rovereto.
(A cura di Medea Zanoli, Università degli Studi di Trento)
A partire dalla seconda metà del secolo scorso, la meccanica quantistica ha cominciato a ricoprire un ruolo decisivo nella comprensione dei meccanismi biologici, rivelandosi alla base dei più svariati fenomeni della Natura: dalla fotosintesi, alle mutazioni del DNA, alla capacità degli uccelli di orientarsi con il campo magnetico terrestre. All’Università degli Studi di Trento, Albrecht Haase sta indagando come fenomeni di quantum tunneling siano alla base della ricezione degli odori. In questa intervista ci illustrerà l’attività di ricerca che viene svolta nel suo laboratorio di Nonlinear Bioimaging, presso il Centro Interdisciplinare Mente e Cervello (CIMeC) di Rovereto.

Figura 1: laboratorio del CIMeC di Rovereto. La microscopia a due fotoni viene utilizzata per monitorare in vivo l’attività neurale di un’ape sottoposta a stimoli olfattivi.
M: Per cominciare, può fornirci una panoramica generale sulla sua attività di ricerca?
A: La filosofia del nostro gruppo è quella di creare un’interfaccia tra la Fisica e le Neuroscienze. I neuroscienziati, infatti, si occupano troppo spesso solo della fenomenologia del cervello, senza capirne i meccanismi in profondità. Noi invece studiamo processi fisici che sottostanno al funzionamento della rete neurale, avvalendoci di metodi sperimentali sviluppati in altri campi della fisica e che in campo biologico non erano ancora stati applicati. Io, per esempio, prima di arrivare a Trento mi occupavo di ottica quantistica e quando mi è stato proposto dal CIMeC di fondare un nuovo laboratorio di Nonlinear Bioimaging, sono passato dall’osservare singole particelle quantistiche a interi sistemi biologici utilizzando gli stessi metodi sperimentali.
M: Può spiegarci quali sono questi “processi fisici” nel cervello di cui sta parlando?
A: Uno degli aspetti fondamentali di cui ci siamo occupati finora è il meccanismo che sta alla base della ricezione degli odori. Il senso olfattivo è sempre stato considerato un senso “chimico”, contrapposto alla vista e all’udito che sono invece sensi “spettrali”. Nel modello generale, un odore viene percepito quando una molecola si lega chimicamente a un recettore del naso, che se stimolato invia un impulso al cervello. Il legame chimico è dovuto alle dimensioni e alla forma della molecola e ai gruppi funzionali che la compongono. Se l’olfatto funzionasse solo in questo modo, molecole che hanno una struttura chimica diversa dovrebbero essere sempre percepite come odori distinti, ma qui troviamo una contraddizione: ci sono molecole la cui struttura chimica è molto diversa, ma che noi percepiamo come odori assolutamente identici. Facciamo un esempio: l’odore delle mandorle è codificato in venti diverse molecole, una di queste è l’acido cianidrico, molecola lineare costituita da soli tre atomi, un’altra è il benzaldeide, una molecola aromatica a forma di anello. La struttura chimica non potrebbe essere più diversa, eppure l’odore percepito è lo stesso!
Una soluzione a questa contraddizione arrivò circa venti anni fa dal biofisico libanese Luca Turin, che propose l’esistenza di una componente spettrale nel senso olfattivo, come nella vista e nell’udito. La percezione degli odori sarebbe legata ai livelli energetici vibrazionali delle molecole in questione.

Figura 2: il recettore olfattivo è costituito da un anello di proteine. Nel modello generale (shape theory) l’interazione tra il recettore e la molecola di odore è una reazione chimica, dipendente dalla forma della molecola e dai gruppi funzionali che la compongono. Nel modello proposto da Luca Turin (molecule vibration theory), l’interazione dipende dai modi vibrazionali della molecola.
Proverò a spiegare in modo semplice il meccanismo proposto da Turin: il recettore olfattivo è costituito da un anello di proteine, all’interno del quale possiamo immaginare di trovare due molecole, una con più elettroni (donore) e una con meno elettroni (accettore). I livelli energetici occupati dagli elettroni del donore sono più alti di quelli dell’accettore. Il passaggio di un elettrone tra le due molecole può avvenire solo se l’elettrone perde in qualche modo l’energia in eccesso. Il gap è tipicamente dello stesso ordine delle energie coinvolte nelle transizioni vibrazionali delle molecole. Quindi, se una molecola i cui modi vibrazionali sono in risonanza con questo gap entra nel recettore, l’elettrone può eccitare la molecola, cedendole la sua energia in eccesso, e passare per effetto tunnel dal donore all’accettore. Questo processo provoca l’invio di un impulso al cervello e la ricezione dello stimolo olfattivo.
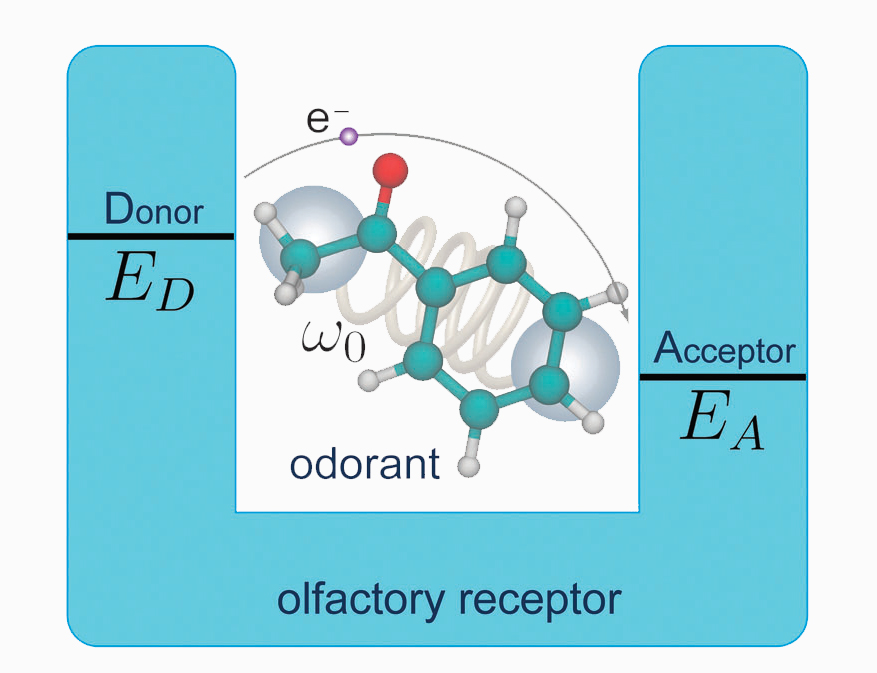
Figura 3: donor – acceptor bridge model. Un elettrone può passare per effetto tunnel dal donore all’accettore se i modi vibrazionali della molecola sono in risonanza con il gap energetico tra donore e accettore. Solov’yov, I.A., Chang, P.-Y., and Schulten, K. “Vibrationally assisted electron transfer mechanism of olfaction: myth or reality?” Phys. Chem. Chem. Phys. 14, 13861 (2012). DOI: 10.1039/c2cp41436h.
In realtà non si conosce ancora la struttura completa del recettore, quindi nessuno ha ancora individuato gli accettori e i donori, ma nel codice genetico sono stati trovati dei buoni candidati, e il donor–acceptor bridge model rappresenta quindi un modello plausibile per spiegare la ricezione degli odori.
M: E’ un fenomeno che avete teorizzato, ma non ancora direttamente osservato?
A: Non conosciamo la struttura del recettore, ma c’è un modo per comprovare la nostra ipotesi: ci servono due molecole con le stesse proprietà chimiche ma diversi spettri vibrazionali; se l’odore percepito cambia, allora è giusto supporre che anche nel senso olfattivo ci sia una componente spettrale. Per far questo, è sufficiente sostituire nelle molecole alcuni elementi con i rispettivi isotopi, ad esempio idrogeno con deuterio. Molecole del genere sono chiamate isotopomeri. In questo modo le proprietà di legame chimico rimangono immutate, ma i picchi di risonanza nello spettro vengono traslati, modificando il fenomeno di tunneling di cui abbiamo parlato. Se tali inelastic electron tunneling effects ipotizzati da Turin avvengono realmente, isotopomeri diversi dovrebbero provocare sensazioni olfattive diverse. Noi abbiamo osservato questo fenomeno per la prima volta nel cervello delle api. Abbiamo sottoposto agli animali isotopomeri con diverso grado di deuterazione e abbiamo monitorato l’attività neurale in vivo: abbiamo rilevato che maggiore è la deuterazione, maggiore è la differenza dell’odore percepito.
M: Come fate a capire qual è l’odore percepito dall’ape?
A: Nel cervello delle api c’è una struttura tridimensionale chiamata “lobo antennale”, che ha la stessa struttura del nostro bulbo olfattivo. Qui la rete neurale presenta dei nodi in cui convergono tutti gli stimoli olfattivi di una certa famiglia di recettori. Nel cervello l’attività elettrica dei neuroni è legata a fluttuazioni della concentrazione di ioni di calcio. Se inseriamo nei neuroni un fluoroforo che cambia il suo stato dipendentemente dalla concentrazione di calcio, osserviamo dei fenomeni di fluorescenza che sono indici dell’attività neurale. In pratica, siamo in grado di monitorare in vivo quali nodi si accendono, e quindi quale odore è stato percepito. Questa tecnica si chiama calcium imaging.
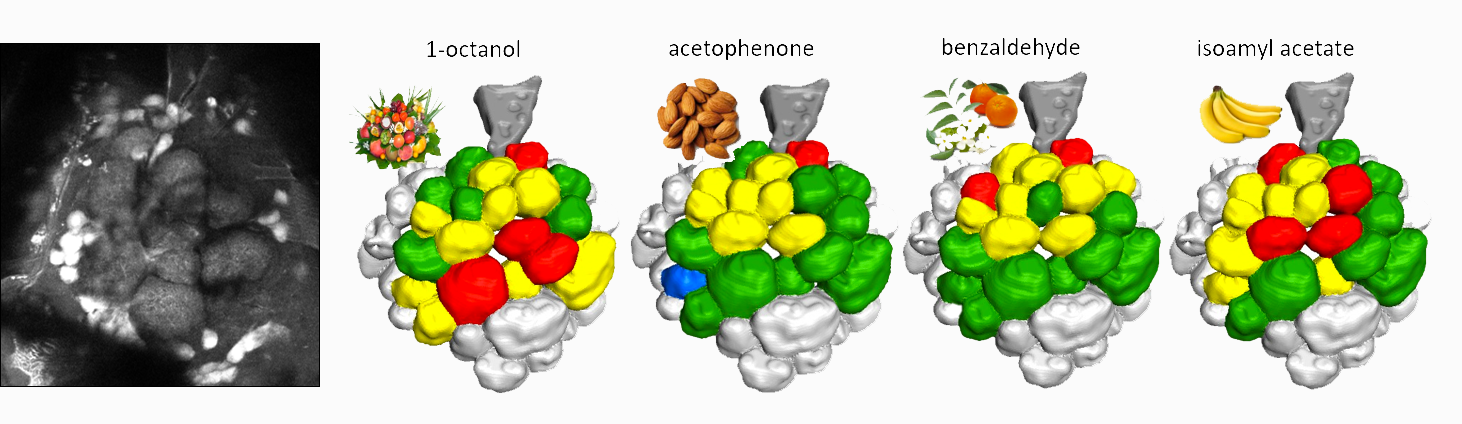
Figura 4: attività neurale del lobo antennale di un’ape in seguito alla percezione di odori diversi. Nelle api il lobo antennale è l’area del cervello deputata alla ricezione degli odori (l’equivalente nell’uomo prende il nome di bulbo olfattivo). Nel disegno vengono schematizzati i nodi della rete neurale, la cui accensione, monitorata in vivo, dipende dagli stimoli olfattivi cui l’ape viene sottoposta.
M: Può spiegare più nel dettaglio come funziona l’esperimento?
A: Per risponderti devo fare un passo indietro, e spiegare come funziona l’apparato sperimentale. I nostri esperimenti si basano su un metodo chiamato two photon excited fluorescence. Per ottenere un fenomeno di fluorescenza, si può eccitare una molecola con un laser, provocando una transizione dallo stato fondamentale a uno stato eccitato; dopo un certo periodo di tempo, la molecola si rilassa tornando allo stato fondamentale ed emettendo un fotone. I nostri fluorofori si eccitano tipicamente nel blu, quindi occorrerebbe un laser blu per provocare la fluorescenza.
Noi usiamo un trucco: invece di utilizzare un unico fascio, ne utilizziamo due, ognuno con metà dell’energia necessaria alla transizione molecolare, quindi nel nostro caso lavoriamo nell’infrarosso. I due fasci vengono focalizzati fortemente in unico punto, detto “punto di fuoco”, tramite un sistema di lenti. Se l’intensità totale è sufficientemente elevata, esiste una buona probabilità che due fotoni incidano sulla molecola contemporaneamente, causando la stessa transizione che provocherebbe un unico fotone doppiamente energetico.
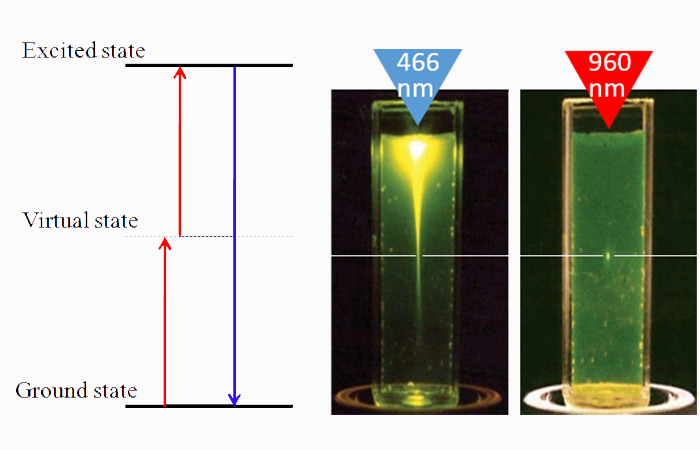
Figura 5: a sinistra, l’arrivo simultaneo di due fotoni nell’infrarosso può provocare in una molecola la stessa transizione energetica che avverrebbe con l’arrivo di un unico fotone nel blu, grazie alla formazione di un livello energetico “virtuale” tra il ground state e lo stato eccitato. A destra, nella spettroscopia a due fotoni i fasci risultano fortemente focalizzati unicamente nel punto di fuoco, contrariamente alla microscopia a un fotone in cui l’intensità decresce con la distanza. Nei tessuti biologici questo permette di limitare i danni al punto di fuoco. Zipfel, W.R., Williams, R.M., and Webb, W.W. Nonlinear magic: multiphoton microscopy in the biosciences. Nat. Biotechnol. 21, 1369–1377 (2003). DOI:10.1038/nbt899.
Questa tecnica presenta svariati vantaggi rispetto a quella a un solo fotone. Innanzitutto, richiedendo l’assorbimento simultaneo di due fotoni, si induce la fluorescenza unicamente nel punto di fuoco. Questo perché la probabilità del processo a due fotoni è proporzionale al quadrato dell’intensità incidente, che risulta apprezzabilmente alta unicamente nel punto di fuoco, aumentando considerevolmente la risoluzione.
Questa selettività offre dei vantaggi anche nel limitare i danni ai tessuti biologici, dovuti alla produzione di radicali liberi nel processo di irradiazione, riducendoli unicamente al punto di fuoco; ciò rende questa tecnica particolarmente adatta all’imaging in vivo. Un ulteriore vantaggio proviene dal fatto che la profondità di penetrazione della radiazione incidente aumenta all’aumentare della lunghezza d’onda; normalmente i fluoforori vengono eccitati nel blu, ma usando un processo a due fotoni la lunghezza d’onda usata è nell’infrarosso, in tal modo si riesce a penetrare fino a circa mezzo millimetro. Nel caso del cervello di un’ape, vuol dire penetrarlo del tutto.
M: Come mai ha scelto le api?
A: In realtà la scelta delle api è stata dovuta a motivi burocratici. In principio avremmo voluto utilizzare i tipici animali da laboratorio, come topi e pesci, ma quando ormai tutto l’apparato sperimentale era stato costruito, mancava ancora il luogo in cui tenere gli animali da laboratorio. Qui al Cimec alcuni colleghi utilizzavano già le api per altri esperimenti, e così le “prendemmo in prestito” anche per il nostro esperimento. Solo dopo mi sono reso conto di quanto incredibili siano le api, il modo in cui riescono a distinguere gli odori è pazzesco: in odori che per me sono identici, le api riescono a percepire la minima impurità. Addirittura, riescono a percepire un’impurità di 5 parti per milione. Questo non va semplicemente oltre le capacità olfattive dell’uomo, ma è addirittura più sensibile dei nostri stessi macchinari, che si basano su metodi molto sensibili come la spettroscopia di massa e la gascromatografia. Nelle api vediamo quindi anche un potenziale nel campo dei bio-inspired sensors: se riuscissimo a imitare i recettori delle api, saremmo in grado di costruire “nasi elettronici” molto più sensibili dei nostri attuali macchinari. Adesso intendiamo continuare a studiare le api; la nostra prossima sfida è capire come fanno a codificare così tante informazioni così velocemente.
-
live_help La gascromatografia
La gascromatografia è una delle tecniche analitiche più potenti nella chimica analitica organica. Viene utilizzata per analisi quantitative di miscele di molecole organiche, senza che queste subiscano decomposizione (ovvero la separazione di un composto chimico nelle sue parti elementari). L’ iniettore vaporizza il campione, lo diluisce in un flusso di gas inerte (elio, azoto, argon, idrogeno), detto “gas di trasporto”, alla stessa temperatura. Il campione viene trasportato dal gas inerte all’interno di una colonna cromatografica, all’uscita della quale si trova un detector. Lungo questa colonna le sostanze della miscela sono separate in base al loro peso molecolare, alla velocità del gas di trasporto, alle loro interazioni specifiche con il rivestimento interno della colonna e alla loro temperatura, che può essere variata mediante un forno. Le sostanze così separate escono dalla colonna per entrare in un detector che le rileva.
-
live_help La spettrometria di massa
La spettrometria di massa è una tecnica analitica per separare in un composto particelle e molecole con rapporto massa/carica diverso. In una tipica procedura di spettrometria di massa il campione, tipicamente in fase gassosa, viene ionizzato, ad esempio mediante bombardamento con elettroni. Il bombardamento può causare la frammentazione delle molecole in ioni. Questi, sottoposti a campi elettrici e magnetici, vengono accelerati e subiscono una deflessione che dipende dal loro rapporto massa/carica. In questo modo, ioni con rapporto massa/carica diversa vengono separati gli uni dagli altri. Gli ioni vengono rivelati da un detector in grado di rivelare particelle cariche, come ad esempio un moltiplicatore di elettroni. La misura fornisce uno spettro dell’abbondanza relativa degli ioni rivelati. Gli atomi o le molecole presenti nel campione possono essere identificate attraverso un modello caratteristico di frammentazione che correli le masse rivelate con le molecole originarie, precedenti alla frammentazione.
M: Come mai ha scelto di dedicarsi a questo argomento?
A: Quando venni a Trento cercavo un posto come ricercatore in ottica quantistica. Poiché durante il Post Doc avevo già utilizzato il sistema a due fotoni, mi fu proposto di fondare un nuovo laboratorio di nonlinear bio-imaging. L’ho accettato come sfida, ma si è rivelato più interessante di quanto potessi immaginare: questa tecnica è così universale che permette di studiare sistemi molto diversi, dalle particelle quantistiche al cervello degli insetti, ma anche ad esempio le cellule tumorali nei tessuti umani.
M: All’interno del vostro gruppo di ricerca ci sono possibilità di tesi?
A: Assolutamente sì! Nel nostro gruppo di ricerca abbiamo una lunga lista di progetti che vorremmo iniziare, ma pochissima manodopera. Accettiamo volentieri tesi di magistrale o dottorato, o progetti di internship. Io già da due anni cerco qualcuno che studi i meccanismi quantistici alla base della magnetoricezione negli animali. Ad esempio gli uccelli migratori riescono a seguire sempre la stessa rotta probabilmente seguendo i campi magnetici terrestri. Una ipotesi è che in gioco ci sia una coppia di elettroni entangled, che si possono trovare o in uno stato di singoletto o di tripletto. I due stati reagiscono in modo diverso con il campo magnetico terrestre e parrebbe che il cervello degli uccelli sia in grado di determinare la propria posizione valutando la proporzione tra questi due stati. Vorremmo studiare l’esistenza di un processo simile anche nell’orientamento delle api. Adesso avrei tutto pronto per partire con questa nuova ricerca, ma non riesco a trovare uno studente che sia interessato a iniziarla! I neuroscienziati sono troppo spaventati dalla fisica e dalla matematica, e i fisici non pensano che questa sia “vera scienza”.
In conclusione, se siete non siete tra quei fisici che ritengono sia indegno invocare la meccanica quantistica per spiegare la biologia, il CIMeC di Rovereto può offrivi la possibilità di inoltrarvi in questo nuovo e (ancora) inesplorato mondo della Quantum Biology.
Contatti utili

“L’olfatto quantistico delle api” di Medea Zanoli, Associazione Italiana Studenti di Fisica, è distribuito con Licenza Creative Commons Attribuzione - Non commerciale - Non opere derivate 4.0 Internazionale.