L'adroterapia contro i tumori
FOOT: il nuovo esperimento dell’INFN.
(A cura di Francesca Neri e Francesca Neri, Alma Mater Studiorum - Università di Bologna)
Danni da radiazione
Nella prima metà del ‘900 il mondo impazziva per qualsiasi prodotto “salutistico” che dichiarasse di contenere Radio, elemento radioattivo appena scoperto e amato dalle folle per la caratteristica “magica” di brillare al buio. Infatti, nonostante le radiazioni ionizzanti fossero state scoperte alla fine del XIX secolo e la comunità scientifica avesse già avuto prova della loro pericolosità per la salute dell’uomo, i danni causati ai tessuti biologici furono riconosciuti anche dall’opinione pubblica solo molti anni più tardi. Il principale colpevole fu il marketing sfrenato dei tempi, che era addirittura arrivato a vendere prodotti di bellezza e tavolette di cioccolato radioattive.

Figura 1: Pagina del giornale New-York Tribune del 23 febbraio 1919 in cui vengono pubblicizzati i prodotti per il viso della marca Radior. New-York Tribune, February 23, 1919, retrieved from the Library of Congress (1866).
Seppure i ciarlatani avessero avuto la meglio sul pensiero comune, i danni provocati dalle radiazioni ionizzanti furono in realtà da subito studiati dai ricercatori e sfruttati in ambito medico. Ma cosa sono le radiazioni ionizzanti? E perchè sono dannose? Si definisce ionizzante una radiazione che trasporta una quantità sufficiente di energia tale da liberare elettroni dagli atomi e dalle molecole costituenti la materia irradiata. Una radiazione di questo tipo può essere costituita sia da raggi X o γ, appartenenti alla banda più energetica dello spettro elettromagnetico, sia da particelle ad elevata velocità (come elettroni, protoni e particelle alpha).
Quando le radiazioni ionizzanti si propagano in un materiale organico, le interazioni che hanno luogo variano a seconda del tipo di radiazione, dell’energia e del mezzo attraversato. Più in generale, queste interagiscono con le cellule producendo ionizzazioni ed eccitazioni sia nelle macromolecole costituenti il DNA sia nell’acqua contenuta all’interno delle cellule. Nel primo caso viene generato un danno direttamente alla doppia elica del DNA, nel secondo vengono invece prodotti dei radicali liberi che causano danni indiretti alle molecole. L’azione di entrambi i meccanismi può portare alla morte cellulare, intesa come “morte riproduttiva” ovvero come la perdita della capacità della cellula di proliferare.
-
live_help Morte cellulare
Alla base dell’attivazione del processo di morte cellulare vi è il gene c-myc il quale induce la proliferazione nel caso in cui la cellula si trovi in presenza di determinati fattori di sopravvivenza. In caso contrario, esso innesca l’apoptosi, un meccanismo di autodistruzione della cellula che, attraverso processi metabolici preordinati, porta a una specie di dissoluzione cellulare.
Quest’ultima è infatti dotata di meccanismi sia di autoriparazione della catena del DNA, che entrano in funzione in presenza di danni facilmente riparabili (Single Strand Break), sia di autosalvaguardia, come il gene p53 che interrompe l’accrescimento e la divisione cellulare nel caso in cui vengano rilevati dei danni che la cellula non è in grado di riparare (Double Strand Break).
-
live_help Single/Double Strand Break
Si ha una Single Strand Break (SSB) quando una delle due catene del DNA è danneggiata, mentre l’altra rimane intatta. Il meccanismo di riparazione cellulare è in questo caso piuttosto semplice: il tratto di catena che riporta la rottura viene "asportato", ricostruito a partire dall’informazione intatta nella catena complementare ed infine ricollegato. A differenza delle SSB, le Double Strand Break (DSB) sono più difficili da riparare e sono la causa principale di morte cellulare o di mutazione genetica da cui può seguire la formazione di una neoplasia. Ciò è dovuto al fatto che in presenza di DSB entrambe le catene risultano danneggiate nella medesima posizione e quindi l’informazione non è recuperabile.
Se le radiazioni ionizzanti sono in grado di portare a morte cellulare, allora perché non sfruttarle per colpire le cellule tumorali?
Tecniche oncologiche con radiazioni ionizzanti
Seppure alla fine del 1800 i meccanismi cellulari non fossero ancora ben noti, una cosa era già certa: le radiazioni ionizzanti erano in grado di eliminare le cellule. Tale nozione fu sufficiente per dare inizio alle prime sperimentazione di una tecnica oncologica basata sull’irraggiamento del tessuto canceroso attraverso radiazioni elettromagnetiche X e γ, trattamento che prese il nome di radioterapia. A decretare la nascita della radioterapia fu il primo successo clinico con raggi X ottenuto da Emil Grubbe nel 1896 (solo un anno più tardi la scoperta dei raggi X da parte di Röntgen) su una paziente affetta da cancro al seno.
Dai primi risultati ottenuti sul finire dell’800, questo trattamento è stato sempre più sviluppato. A partire dalle obsolete “bombe al cobalto” (che irradiavano i pazienti con radiazioni gamma emesse dal radioisotopo cobalto-60), fino alle più moderne tecniche radioterapiche con LINAC (LINear ACcelerator), la radioterapia ha svolto e svolge tutt’ora un ruolo fondamentale nella lotta al cancro.
Dalla metà del ‘900, il rapido progresso tecnologico nella fisica degli acceleratori ha permesso la nascita di una seconda tecnica oncologica molto simile alla convenzionale radioterapia. Si tratta dell’adroterapia: trattamento oncologico che prevede l’irraggiamento del volume tumorale attraverso fasci di protoni o ioni pesanti. Seppure radio e adroterapia si basino sul medesimo principio di funzionamento, l’energia è depositata in funzione della profondità in modo diametralmente opposto. La radioterapia utilizza radiazioni elettromagnetiche ad energie di qualche MeV che interagiscono con la materia rilasciando grandi quantità di energia solo nei primi strati di tessuto fino a una profondità dell’ordine di qualche centimetro. L’adroterapia utilizza invece particelle cariche pesanti ad energie dell’ordine di centinaia di MeV per nucleone, che interagiscono con i nuclei bersaglio essenzialmente per ionizzazione e frammentazione nucleare. L’andamento del rilascio di energia per ionizzazione in funzione della profondità è descritta dalla formula di Bethe-Bloch e risulta direttamente proporzionale al quadrato della carica delle particelle del fascio e inversamente proporzionale al quadrato della loro velocità. Per cui nel canale d’entrata, dove le particelle hanno velocità molto elevate, viene rilasciata poca energia. Al diminuire della velocità l’aumento del dE/dx (energia rilasciata per unità di lunghezza) può essere poi visto come l’incremento della densità di ionizzazione alla fine del percorso dello ione. Questo si arresta cedendo completamente la sua energia in una regione di spazio limitata (regione di picco di Bragg) causando quindi ingenti danni alle cellule circostanti.
L’idea che diede vita a questa nuova tecnica fu di Robert Wilson, uno dei fondatori del FermiLab, il quale pensò di sfruttare il profilo di dose caratteristico dei protoni (o di ioni più pesanti) per colpire i tumori più profondi, altrimenti difficilmente trattabili. Tale profilo (riportato in Figura 2.a) presenta infatti un massimo (picco di Bragg), alla fine del cammino della particella nel mezzo, che permette una migliore localizzazione della dose nel volume tumorale limitando i danni ai tessuti sani circostanti (come si può osservare dalla Figura 2.b).
-
live_help Dose assorbita
Poiché tutti gli effetti fisici, chimici (e di conseguenza anche biologici) indotti dalle radiazioni si manifestano a seguito di una cessione di energia in una certa porzione di materia, è stata definita una quantità, la dose assorbita, che coincide con l’energia assorbita per unità di massa del mezzo irradiato. La dose assorbita fa parte delle grandezze fisiche “dosimetriche”, definite allo scopo di descrivere le varie fasi di trasferimento di energia dalle radiazioni alla materia. L’unità di misura nel SI è il Gray (Gy).
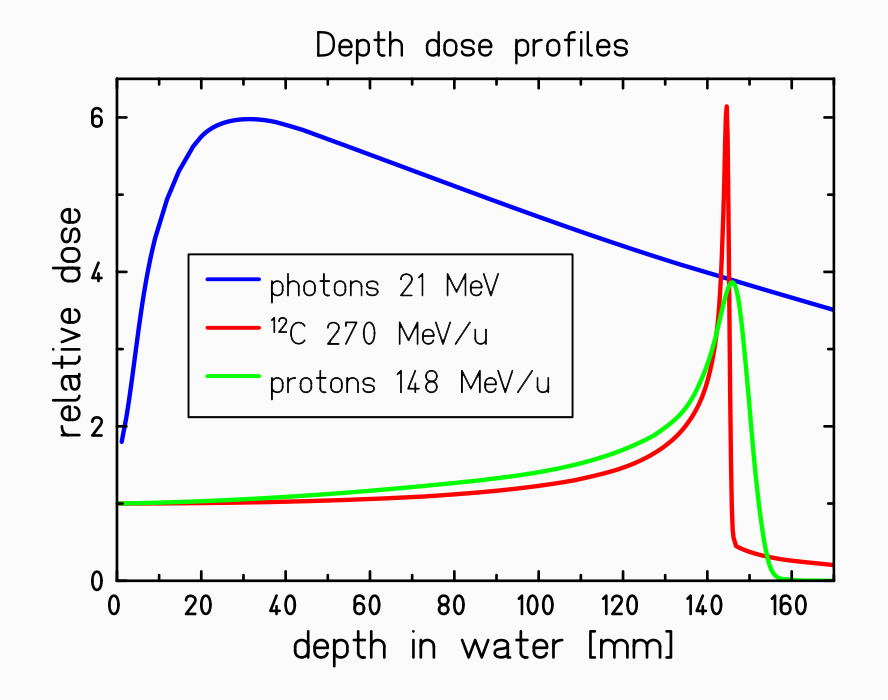
Figura 2a: Distribuzione di dose in funzione della profondità per fasci di fotoni e ioni carbonio a energie fissate. Nel caso dei fotoni la dose diminuisce esponenzialmente dopo un massimo nel tratto iniziale. Al contrario, per fasci di ioni carbonio presentano un massimo di dose alla fine del tragitto. K. Krämer, M. Durante, “Ion beam transport calculations and treatment plans in particle therapy”, Eur. Phys. J. D 60, 195–202 (2010), CC BY 4.0.
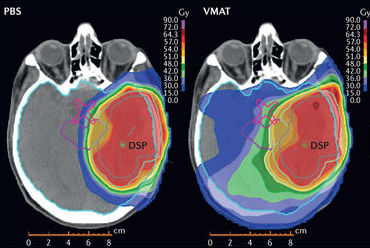
Figura 2b: Confronto tra piani di trattamento differenti. Distribuzioni di dose per terapie con protoni (a sinistra) e fotoni (al centro) per un paziente affetto da un glioma di alto grado (HGG). M. Baumann et al., “Radiation oncology in the era of precision medicine”, Nature Reviews Cancer volume 16, pages 234–249 (2016), doi:10.1038/nrc.2016.18, CC BY 4.0.
La profondità del picco di Bragg è modulata dall’energia del fascio incidente e deve essere accuratamente determinata nei sistemi di pianificazione di trattamento, una volta definito il volume da irradiare. Per ricoprire più efficacemente l’intero volume tumorale (di solito più esteso della larghezza del picco di Bragg), si utilizzano fasci ad energie diverse, ottenendo per sovrapposizione un profilo di irradiazione più ampio, detto Spread Out Bragg Peak (SOBP).
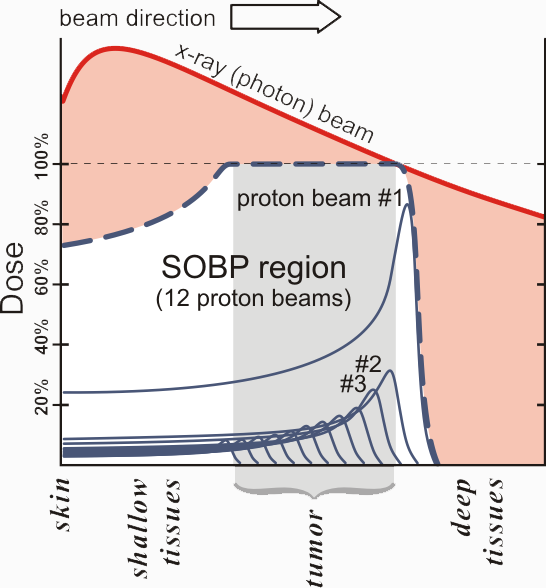
Figura 3: Il grafico mostra il profilo dose di un tipico trattamento adroterapico come SOBP, somma di più picchi di Bragg (linea tratteggiata blu). Per confronto è mostrato in rosso il profilo dose-profondità per un fascio di raggi X. L’area in rosa rappresenta la dose in eccesso per radioterapia rispetto all’adroterapia, che può causare ulteriore danno ai tessuti sani. Immagine distribuita sotto licenza CC BY-SA 3.0, Mark Filipak.
Adroterapia oggi
Attualmente, nel mondo vi sono circa 70 centri clinici che operano con protoni o ioni pesanti e molti altri sono in progettazione anche nei paesi emergenti; di questi solo 11 utilizzano fasci di ioni carbonio. Il numero così esiguo di strutture che offrono trattamenti non solo protonici ma anche con ioni pesanti è dovuto agli alti costi di realizzazione. Vi sono però importanti risultati sperimentali che dimostrano maggiori vantaggi nell’utilizzo di fasci di ioni carbonio rispetto a protoni. Per la realizzazione di nuovi centri in grado di offrire cure adroterapiche con ioni pesanti, sono necessarie conferme sperimentali che assicurino ulteriori sicurezze per futuri investimenti nelle strutture. Un contributo fondamentale a tali ricerche sarà la valutazione degli effetti causati dall’interazione dei fasci terapici con i tessuti biologici, specialmente a causa della frammentazione nucleare.
A dicembre 2017, il PTCOG (Particle Therapy Co-Operative Group), un’istituzione internazionale che monitora tutti i centri adroterapici nel mondo, ha pubblicato una statistica dei trattamenti fino alla fine del 2016, che conta un totale di 174.512 pazienti trattati. All’ammontare di questo numero ha contribuito anche l’Italia, con i suoi tre centri di adroterapia. Il CNAO (Centro Nazionale di Adroterapia Oncologica) di Pavia è attivo dal 2011 e opera sia con fasci di carbonio, sia con fasci di protoni.

Figura 4: Fotografia di una delle una delle sale di trattamento del centro CNAO di Pavia dove il fascio adronico giunge attraverso da un sistema di magneti e collimato sul paziente.
Il CATANA (Centro di AdroTerapia e Applicazioni Nucleari Avanzate) di Catania, dedicato alla cura dei tumori localizzati nella regione oculare, è attivo dal 2002 presso i Laboratori Nazionali del Sud (LNS) dell’INFN (Istituto Nazionale di Fisica Nucleare).
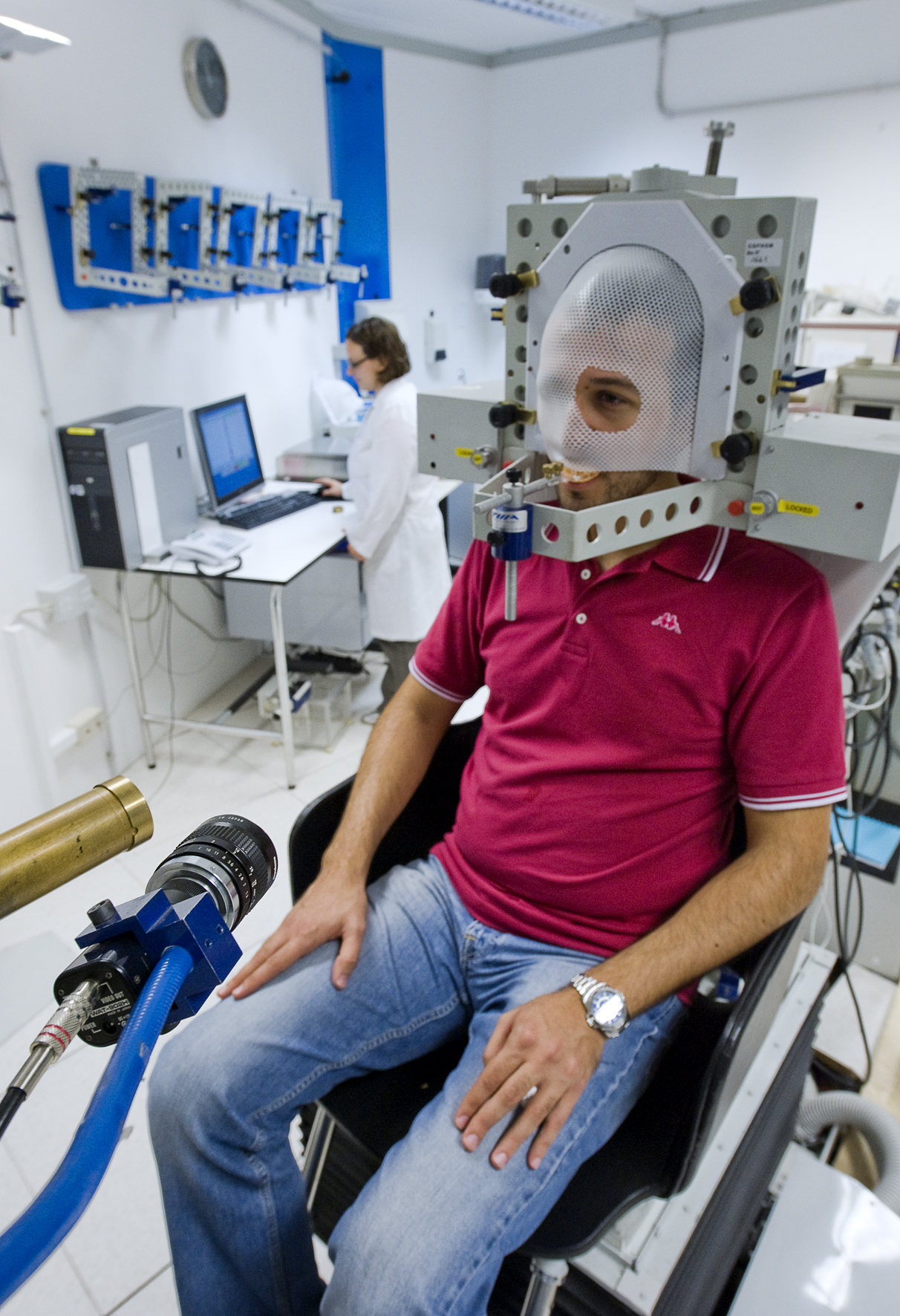
Figura 5: Fotografia scattata presso la sala di trattamento del centro di terapia protonica CATANA (LNS) tratta dall’archivio immagini ufficiale dell’Istituto Nazionale di Fisica Nucleare. Il paziente siede su una sedia realizzata in modo che ogni suo più piccolo movimento sia controllabile via computer ed è immobilizzato all’altezza di testa e collo attraverso una maschera di materiale termoplastico trasparente, modellata sul viso del paziente stesso.
Il PTC (Proton Therapy Center) di Trento è il centro oncologico di adroterapia italiano più recente; è dotato di due camere di trattamento rotanti con fascio protonico orientabile a 360° e di una sala interamente dedicata alla ricerca.
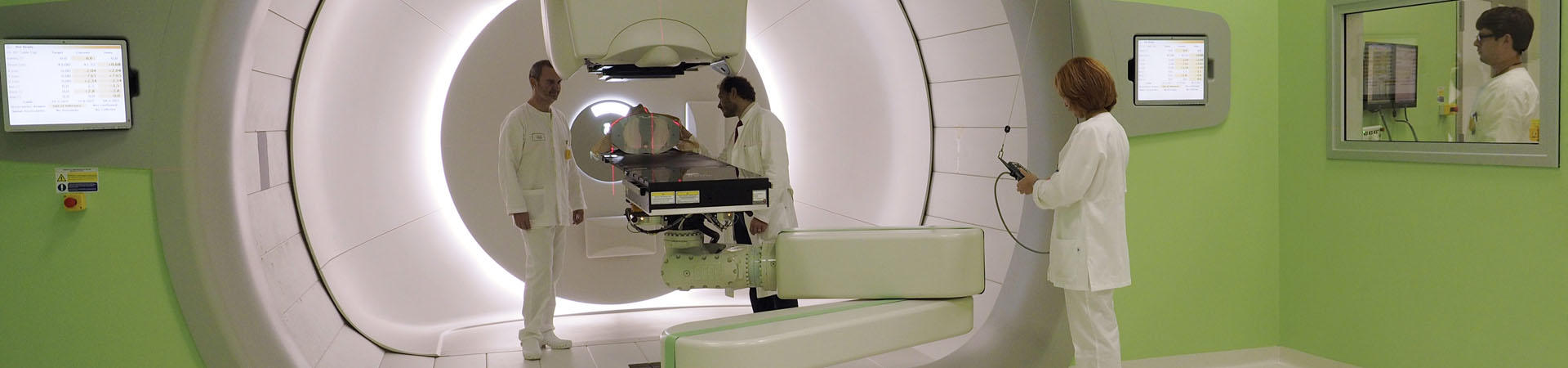
Figura 6: Una delle sale di trattamento del PTC di Trento con fascio protonico orientabile a 360° grazie al sistema rotante posto sulla guida circolare (grigio scuro).
Frammentazione
Quando un fascio di particelle attraversa un mezzo, non avvengono unicamente fenomeni elettromagnetici di ionizzazione o di scattering con gli atomi costituenti il mezzo, ma possono verificarsi anche interazioni con i nuclei degli stessi. Naturalmente, il bersaglio nucleare offre una sezione estremamente piccola rispetto al bersaglio atomico: le sezioni d’urto vanno come il quadrato dei raggi:
\[\mathrm{r_{atomico}}\,= 10^{-10}\,\mathrm{m\, ,\, r_{nucleare}}\,= 10^{-15}\,\mathrm{m}\]I protoni e gli ioni utilizzati in adroterapia hanno energie di centinaia di MeV per nucleone, superiori alla barriera di Coulomb, e possono quindi interagire fortemente con i nuclei bersaglio causandone la frammentazione e/o frammentandosi loro stessi (fatta eccezione per i protoni che non possono ovviamente frammentare nei tre quark di cui sono composti, saldamente legati tra di loro dalla forza nucleare forte). Per questi fasci terapici il contributo energetico dei frammenti secondari prodotti diventa importante, soprattutto per una corretta pianificazione del trattamento.
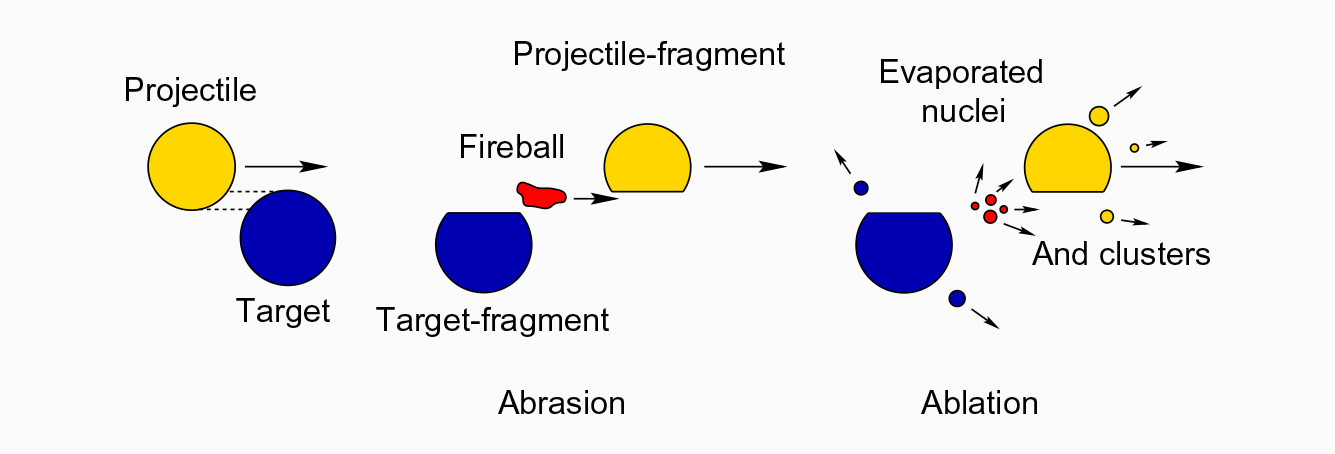
Figura 7: Illustrazione del modello di frammentazione detto “abrasione-ablazione”. K Gunzert-Marx et al., “Secondary beam fragments produced by 200 MeV u−1 12C ions in water and their dose contributions in carbon ion radiotherapy”, New J. Phys. 10 075003 (2008).
La produzione di frammenti con range e direzione diversi rispetto a quelli degli ioni primari non può essere ignorata nella pianificazione di un trattamento di adroterapia, poiché questi frammenti incidono sulla dose rilasciata ai tessuti sani nei pressi del volume tumorale, compromettendo l’efficacia della terapia.
Essendo l’adroterapia una tecnica ancora in sviluppo, manca ad oggi una stima completa degli effetti nocivi causati dagli eventi di frammentazione nucleare tra le particelle del fascio terapico e il materiale biologico del paziente. Negli ultimi anni alcuni esperimenti si sono dedicati alla misurazione della sezione d’urto della frammentazione nucleare per fasci di ioni carbonio. Queste ricerche hanno ottenuto importanti dati sperimentali riguardanti però solamente i frammenti del fascio proiettile e solo per energie in un certo range. Una delle sfide sperimentali riguarda la rivelazione dei frammenti del bersaglio: derivati da nuclei a riposo, questi frammenti vengono emessi con velocità molto basse e si arrestano quindi in spazi dell’ordine del µm con una bassissima probabilità di raggiungere i rivelatori.
FOOT (FragmentatiOn Of Target)
Per colmare queste lacune sperimentali è stato ideato l’esperimento FOOT (FragmentatiOn Of Target), progetto dell’INFN approvato nel settembre del 2017, che vanta una collaborazione internazionale con Germania e Giappone. FOOT si occupa della misura della sezione d’urto dei frammenti prodotti nell’interazione tra particelle cariche (protoni e ioni pesanti come C, He, O) e tessuti biologici, con una precisione inferiore al 5%.
Per ovviare alla difficoltà di rivelazione dei frammenti del bersaglio, FOOT utilizza la tecnica chiamata cinematica inversa. Invece di registrare i frammenti prodotti dall’interazione del fascio protonico accelerato su un paziente, con la cinematica inversa è il paziente ad essere accelerato su un target di protoni! Ovviamente, non potendo lanciare un paziente vero e proprio a velocità relativistiche, quelli a venire accelerati sono dei fasci costituiti dai componenti principali del sistema biologico umano (come 12C e 16O). I frammenti prodotti in cinematica inversa hanno energie più elevate e percorrono distanze maggiori, permettendone così la rivelazione. Una volta effettuate le misure nel sistema di riferimento con i “pazienti incidenti”, si applica il boost inverso e si ottengono le misure nel sistema di riferimento in cui i nuclei del paziente si trovano a riposo.
Per simulare il fascio protonico in quiete non viene utilizzato un bersaglio composto da soli atomi di H (come verrebbe subito da pensare), in quanto sarebbe possibile solamente allo stato gassoso e ciò comporterebbe una probabilità di interazione bassissima. Per riprodurre il comportamento dell’idrogeno, vengono utilizzati due bersagli solidi, uno di carbonio C e l’altro di polietilene C2H4. La sezione d’urto differenziale relativa a un bersaglio di H si ottiene dalla sottrazione dei contributi dei due bersagli:
\[\frac{\textrm{d}\sigma}{\textrm{d}E_{kin}}(\textrm{H})=\frac{1}{4}\left(\frac{\textrm{d}\sigma}{\textrm{d}E_{kin}}(\textrm{C}_2\textrm{H}_4) - 2\frac{\textrm{d}\sigma}{\textrm{d}E_{kin}}(\textrm{C})\right)\]L’apparato sperimentale di FOOT è stato ideato ad hoc in base all’accuratezza e alla risoluzione richieste per la misura e alle caratteristiche geometriche del bersaglio.
-
live_help Caratteristiche geometriche del bersaglio
La scelta delle dimensioni del bersaglio, ad esempio, è stata fatta in modo che i fenomeni di scattering al loro interno fossero ridotti al minimo, così da minimizzare il deterioramento delle misure dovuto alla deviazione dalla traiettoria originale degli ioni proiettile e dei frammenti prodotti. Questa condizione limita lo spessore del bersaglio a 2 mm e di conseguenza limita anche la probabilità di frammentazione al loro interno a 10-2 (in media un fenomeno di frammentazione ogni 100 particelle incidenti).
Per l’esperimento sono stati progettati due diversi setup: uno per la rivelazione dei frammenti più pesanti, uno invece per quelli più leggeri (Z<3).
La struttura complessiva del setup per la rivelazione dei frammenti più pesanti può essere suddivisa in tre regioni: una parte iniziale contenente il bersaglio, la parte dedicata al tracciamento e la parte finale adibita all’identificazione del frammento. Ogni regione è composta da specifici rivelatori adibiti alle misure di traiettoria, energia cinetica, tempo di volo, impulso e Stopping Power (dE/dx) dei frammenti prodotti nel bersaglio.
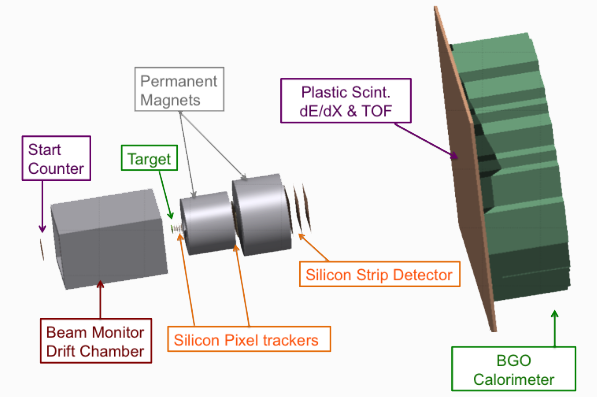
Figura 8: Schematizzazione dell’apparato sperimentale di FOOT, FOOT Conceptual Design Report (CDR).
-
live_help Rivelatori
Il funzionamento dei rivelatori si basa sulla lettura di segnali elettronici derivati dalla ionizzazione o eccitazione degli atomi del materiale attraversato da particelle cariche. I rivelatori a ionizzazione raccolgono direttamente gli elettroni liberati e gli ioni positivi (di solito in un gas) “trasformandoli” in segnali elettronici. I più utilizzati sono i rivelatori a semiconduttore come Silicon Pixel Detector, Microstrip Detector, Drift Chamber. Nei contatori a scintillazione si sfrutta invece la luce emessa nel passaggio da stato eccitato a stato fondamentale degli atomi e delle molecole del materiale scintillatore precedentemente eccitate dal passaggio delle particelle cariche. I fotoni, essendo neutri, per essere rivelati debbono interagire e dar luogo a particelle cariche (sono queste ultime che vengono “registrate”).
La regione precedente il bersaglio è formata da uno Start Counter, ovvero un foglio scintillatore che fornisce l’informazione dell’istante iniziale in cui avviene il passaggio del fascio (fondamentale per la misura del tempo di volo), e da una camera di ionizzazione a deriva (Drift Chamber) che traccia il percorso del fascio prima che questo raggiunga il bersaglio.
-
live_help Drift Chamber
La camera a deriva è formata da 12 strati di fili anodici, ognuno dei quali è posizionato tra due piani catodici. Il passaggio di una particella ionizzante genera nel gas contenuto nella camera (80% aria, 20% CO2 a pressione atmosferica) ioni positivi ed elettroni che si muovono rispettivamente verso i due piani catodici e verso il filo anodico più vicino, nella cui zona limitrofa ha luogo una produzione a valanga di elettroni. Nel filo più vicino viene generato un impulso positivo (che funge da segnale), mentre nei fili adiacenti sono generati impulsi negativi.
A valle della Drift Chamber sono posti i due bersagli di polietilene e carbonio, seguiti a loro volta da un sistema di tracking formato da due magneti permanenti che curvano la traiettoria dei frammenti e da tre rivelatori al silicio che ne rivelano il passaggio prima, a metà e dopo i magneti. Questo dispositivo permette di misurare l’impulso delle particelle cariche a partire dall’angolo di deflessione della loro traiettoria. La regione terminale dell’apparato FOOT è composta da due strati di scintillatori plastici adibiti alla misura del tempo di volo e del dE/dx dei frammenti, seguiti da un calorimetro formato da uno scintillatore inorganico di cristalli BGO che ha la funzione di misurare l’energia dei frammenti.
Il setup ideato per misurare i frammenti più leggeri come protoni, deuterio e nuclei di elio, distribuiti con un’apertura angolare più ampia rispetto a quelli più pesanti, ha la seguente struttura: la regione pre-target è la medesima del setup elettronico per frammenti pesanti ed è formata dallo Start Counter e dalla Drift Chamber mentre i bersagli, lo spettrometro magnetico, i silicon detectors, le barre scintillatrici e il calorimetro sono sostituiti da una camera ad emulsione (vedi Figura 10) che permette di rivelare i frammenti prodotti, emessi fino a 70° rispetto all’asse del fascio incidente. Gli ioni che entrano nella camera ad emulsione attraversano diversi strati di materiale, tra cui delle pellicole ad emulsione nucleare di bromuro di argento (AgBr) che ne registrano il passaggio e perdono energia fino ad arrestarsi. La camera è formata da tre sezioni, ognuna adibita a una specifica funzionalità.
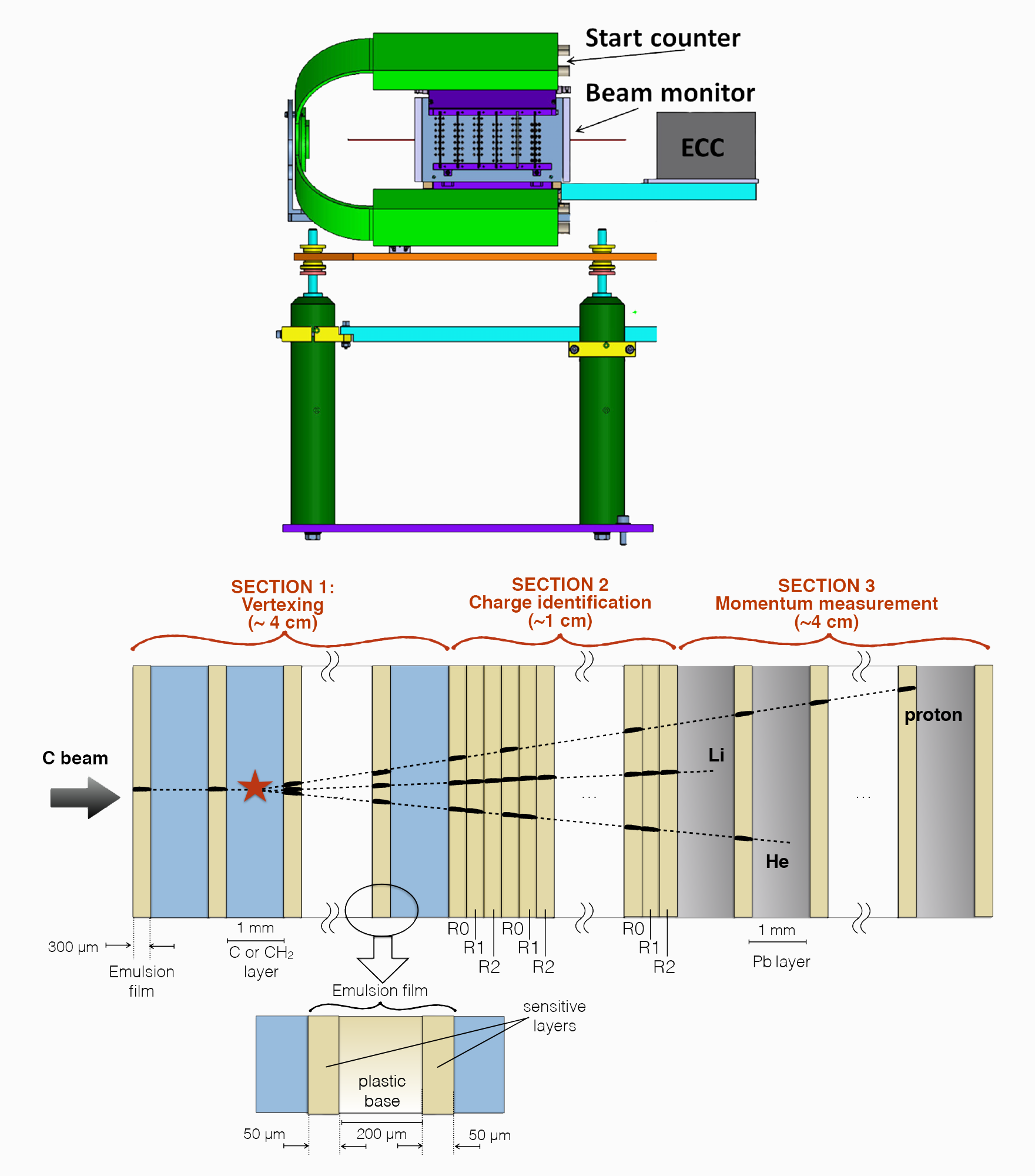
Figura 10: Setup a emulsione per frammenti leggeri e struttura della camera a emulsione, FOOT Conceptual Design Report (CDR).
La prima è formata da tre strati di C o C2H4 (che fungono da bersaglio) spessi 1 mm ciascuno alternati da lastre composte da una base plastica ricoperta da gelatina al bromuro di argento; la seconda è formata da una sequenza di sole pellicole adibita all’identificazione della carica dei frammenti prodotti; la terza è riservata alla misura dell’impulso ed è formata da tre strati di piombo alternati a strati di emulsione. La scelta di utilizzare una camera ad emulsione per le misura a grandi angoli è stata fatta sulla base del fatto che per poter ricoprire 70° con un calorimetro quest’ultimo dovrebbe avere dimensioni di diversi metri che ne impedirebbero la realizzazione per questioni economiche e renderebbero impossibile la portabilità dell’apparato.
FOOT e radioprotezione
La NASA e altre agenzie spaziali hanno iniziato da diversi anni la valutazione del rischio alla salute per astronauti che partecipino a missioni di esplorazione spaziale di lunga durata, come, ad esempio, il primo viaggio su Marte. Lo spazio è un ambiente altamente ostile e le radiazioni cosmiche risultano uno dei maggiori rischi per la salute dell’essere umano. Non esistono infatti stime precise del danno dovuto a radiazioni altamente energetiche e ionizzanti come quelle del vento solare, né contromisure efficaci per la schermatura degli equipaggi spaziali. I dati raccolti dall’esperimento FOOT potranno fornire informazioni essenziali anche in questo campo, indagando in particolare la produzione di frammenti nucleari nell’interazione tra fasci di ioni C e O ad alte energie (fino a 700 MeV/u) e tessuti biologici.
Conclusioni
L’esperimento FOOT ha come finalità il miglioramento della conoscenza dei fenomeni nucleari attraverso la misura delle sezioni d’urto di tutti i frammenti nucleari che si producono quando un fascio adroterapico attraversa il corpo del paziente durante il trattamento. Un aspetto fondamentale in tali misure è l’identificazione univoca dei frammenti prodotti negli urti, realizzata attraverso la misura della loro carica elettrica e della loro massa. Per ottenere questo risultato è importante ricostruire con precisione la traccia dei frammenti rivelati. Della ricostruzione delle tracce, dell’identificazione dei frammenti e del sistema di acquisizione dati si occupa il team di FOOT che ha sede a Bologna e che fa parte di quella grande “catena di montaggio sperimentale” costituita da diversi gruppi di ricerca situati in Italia, Giappone e Germania.
Per le nostre tesi abbiamo avuto la fortuna di lavorare con loro per diversi mesi e di assistere alla fase avanzata di simulazione. Ma non siamo le sole: è possibile leggere e scaricare diversi documenti sull’esperimento, tra cui le tesi (sia magistrali che triennali) degli studenti di fisica che hanno partecipato al progetto. Se vi affascina l’argomento potete approfondire il tema tramite il sito ufficiale.
-
live_help Approfondimenti
F. Neri, "Performance study of Kalman Filter track reconstruction algorithms in the FOOT experiment", francesca.neri18@studio.unibo.it.
F. Neri, "Esperimento FOOT: studi di identificazione di frammenti nucleari", francesca.neri20@studio.unibo.it.
Contatti utili

“L’adroterapia contro i tumori” di Francesca Neri e Francesca Neri, Associazione Italiana Studenti di Fisica, è distribuito con Licenza Creative Commons Attribuzione - Non commerciale - Non opere derivate 4.0 Internazionale.